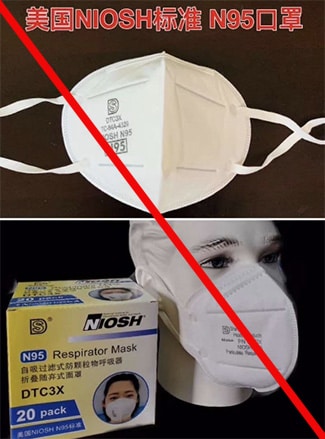
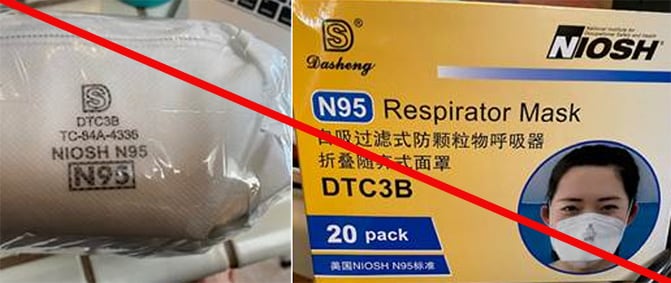
NIOSH son las siglas de: Instituto Nacional
para la seguridad y salud ocupacional
Los N95 aprobados por NIOSH Deberían tener bandas
para la cabeza. .
"Tanto los empleadores, como los empleados deberían
seguir las normas de salud y seguridad establecidas
por la Administración de seguridad y salud ocupacional (OSHA), la comisión conjunta, la Administración de Alimentos y medicamentos
(FDA, pos sus siglas en Inglés),
los centros de servicios de medicare y otras organizaciones "
Copio y pego texto exacto del enlace consultado para éste ítem
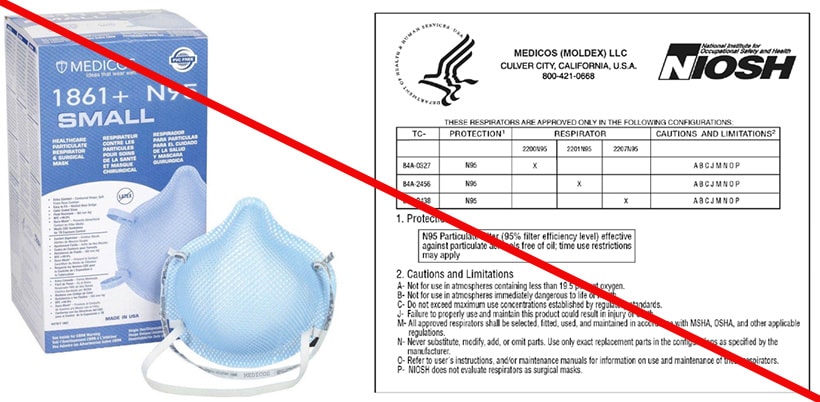
"¿Qué significa que algo cuenta con la aprobación de NIOSH?
Todos los respiradores que se usan en el entorno de la salud deben contar con la aprobación de NIOSH, y son evaluados y probados minuciosamente por NIOSH para que cumplan con los estrictos requisitos federales de seguridad. Para recibir la aprobación de NIOSH, los respiradores deben cumplir con las normas de calidad y funcionamiento establecidas. Solamente entonces autorizará NIOSH a que un fabricante de respiradores use el logo o el nombre de NIOSH en letras mayúsculas en su producto. Los fabricantes deben contar con un programa de calidad establecido que asegure que sus productos cumplen con los requisitos de NIOSH y deben mantener el programa debidamente.
Las marcas de aprobación de NIOSH en los respiradores con mascarilla de filtrado pueden aparecer en la mascarilla misma o en las correas e incluir los elementos que se muestran a continuación. Si un respirador con mascarilla de filtrado tiene marcas de aprobación, pero no aparece en la tabla de NIOSH de respiradores con mascarilla de filtrado aprobados, es probable que se trate de un producto falsificado o cuya certificación ha sido revocada o rescindida por parte de NIOSH. Si no aparece un número que empiece con TC en el paquete del respirador, las instrucciones para el usuario o el producto mismo, entonces no está aprobado por NIOSH. Si no está seguro si su respirador cuenta con la aprobación de NIOSH, puede llamar a NIOSH al 412-386-4000."
FUENTE CONSULTADA:
EQUIPO DE PROTECCIÓN PERSONAL https://www.cdc.gov/spanish/niosh/docs/2013-138_sp/default.html
2) KN 95
serían de origen chino
-KN 95= stándard chino similiar a los que llamamos
N 95
-GB 2626-2006 sería un standard chino para este tipo de máscaras respiratorias
Las máscaras que Circularían en nuestros hospitales
y centros de salud serían éstas.
4)
- La FDA habría recibido datos de pruebas del NIOSH
y la CDC que algunas de las máscaras fabricadas
en China no cumplirían con los criterios esperados
Podés leer acá más información de la fuente que consulté:
Que en Junio 6 2020 -( abrir enlace )
leemos:
"On April 3, 2020, in response to this public health emergency and concerns about filtering
facepiece respirator (FFR or respirator) availability, FDA concluded based on the totality of
scientific evidence available at that time that certain product classifications for imported
disposable FFRs that are manufactured in China and not approved by the Center for Disease
Control and Prevention’s National Institute of Occupational Safety and Health (NIOSH) and for
which data exists to support the respirators’ authenticity, were appropriate to protect the public
health or safety under section 564 of the Federal Food, Drug, and Cosmetic Act (Act) (21
U.S.C. § 360bbb-3). Under the original April 3, 2020 Emergency Use Authorization (EUA),
authorized respirators listed in Appendix A were authorized for use in healthcare settings by
healthcare personnel (HCP)2 when used in accordance with CDC recommendations to prevent HCP exposure to pathogenic biological airborne particulates during FFR shortages resulting
from the COVID-19 outbreak.
On May 7, 2020, in response to questions and concerns that were received by FDA after
issuance of the April 3, 2020 letter, FDA reissued the letter to revise the Scope of Authorization
to address concerns about sub-standard products to protect the public health or safety under
section 564(g)(2)(C) of the Act (21 U.S.C. § 360bbb-3(g)(2)(C)).
3
On June 6, 2020, in response to continued questions and concerns and having concluded that
revising this letter is again appropriate to protect the public health or safety under section
564(g)(2)(C) of the Act (21 U.S.C. § 360bbb-3(g)(2)(C)), FDA is reissuing the May 7, 2020
letter to revise the Scope of Authorization (Section II) and Conditions of Authorization.... "
traducido sería
"El 3 de abril de 2020, en respuesta a esta emergencia
de salud pública y las inquietudes sobre la disponibilidad de respiradores de
careta filtrante (FFR o respirador), la FDA concluyó en base a la totalidad de
la evidencia científica disponible en ese momento que ciertas clasificaciones
de productos para FFR
desechables importados que son fabricados
en China y no
aprobados por el Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH)
del Centro para el Control y la Prevención de Enfermedades y para los cuales
existen datos que respaldan la autenticidad de los respiradores, fueron
apropiados para proteger la salud o seguridad pública según la sección 564 del
Ley Federal de Alimentos, Medicamentos y Cosméticos (Ley 21 USC § 360bbb-3).
Según la Autorización de Uso de Emergencia (EUA) original del 3 de abril de
2020, el personal sanitario autorizó el uso de respiradores autorizados que
figuran en el Apéndice A en entornos de atención médica. (HCP) 2 cuando se usa
de acuerdo con las recomendaciones de los CDC para prevenir exposición de HCP a partículas biológicas patógenas en el
aire durante la escasez de FFR resultante del brote de COVID-19.
El 7 de mayo de 2020, en respuesta a preguntas y
preocupaciones que recibió la FDA después de
emisión de la carta del 3 de abril de 2020, la FDA volvió a
emitir la carta para revisar el alcance de la autorización
para abordar las inquietudes sobre productos de calidad
inferior para proteger la salud o seguridad pública bajo
El 6 de junio de 2020, en respuesta a las preguntas y
preocupaciones continuas y habiendo concluido que
revisar esta carta nuevamente es apropiado para proteger la
salud o seguridad pública en la sección
564 (g) (2) (C) de la Ley (21 U.S.C.§ 360bbb-3 (g) (2) (C)),
la FDA vuelve a emitir el 7 de mayo de 2020
carta para revisar el Alcance de la Autorización (Sección
II) y las Condiciones de Autorización ....
5)
Evaluaciones /reportes de distintas máscaras
KN 95
a modo de ejemplificar
adjunto 3 enlaces correspondientes
de la CDC con distintos fabricantes-
enlaces: 🔻
reporte donde leemos:
-que la NIOSH en la actualidad no estaría aprobando máscaras con bandas en las orejas,
sino bandas en la cabeza;
que los métodos usados no serían
los procedimientos standard que se
usaría para certificarlos en NIOSH sino
uno modificado de NIOSH;
-que los testeados no cumplirían los requisitos
de STP 0059
( que sería una versión modificada de los test stándar de procedimientos de NIOSH;
que de las 10 máscaras recibidas, 3 medían menos del 95%
que No se habrían recibido certificaciones por lo que no
se pudo verificar la autenticidad o no de las mismas,
(No agrego todo el reporte para No hacer más largo esta
publicación pero podés leerlo en donde dice "testeo abril" en inglés)
b) 21 Mayo 2020
enlace:🔻
Reporte donde leemos
-que el producto sería con bandas en orejas
la NIOSH en la actualidad aprobaría máscaras
con bandas en las cabeza
-que No se habrían recibido certificaciones por lo que no
se pudo verificar la autenticidad o no de las mismas
-que habrían enviado 30 máscaras en grupos de 10
-que el máximo filtrado era del 87,30 %, el mínimo
11,10 % y que los 30 enviados medían
Menos del 95%
-que no cumplirían con los requerimientos STP 0059
(No agrego todo el reporte para No hacer más largo esta
publicación pero podés leer éste en donde dice
"otro reporte
de testeo CDC en inglés)
c) Otro testeo Junio 11 , 2020
enlace 🔻
Reporte en que leemos
-que fueron enviados 10 respiradores,
-que el máximo de eficiencia de filtración fué de 96,79%
y el mínimo de 27 %
-Que de los 10 enviados, 7 de ellos midieron
Menos del 95%
y 3 de ellos más del 95%
-que este producto sería con bandas para orejas y que
actualmente NIOSH aprobaría con bandas en cabeza
-que No se habrían recibido certificaciones por lo que no
se pudo verificar la autenticidad o no de las mismas
- (No agrego todo el reporte para No hacer más largo esta
publicación pero podés leer éste en donde dice "11 de Junio 2020"CDC en inglés)
traducción de uno de los párrafos de la página de
este enlace , copio y pego del texto en inglés
"NIOSH ha recibido recientemente nueva
información de las partes interesadas en
los Estados Unidos sobre productos de China
que afirman cumplir con GB2626 y EN149.
Los resultados de la evaluación confirman
que algunos de estos productos tendrían
una eficiencia de filtro pobre y
serían de baja calidad.
NIOSH está trabajando estrechamente
con la FDA para alinear las Autorizaciones
de uso de emergencia para comunicar los
resultados de las pruebas de punto de uso."
"NIOSH has recently received new information from Stakeholders across the United States regarding products from China claiming to meet GB2626 and EN149. Assessment results confirm that some of these products have poor filter efficiency and are of poor quality. NIOSH is working closely with the FDA to align Emergency Use Authorizations to communicate the point of use testing results.
The other countries listed in the guidance and their associated product classifications
| Product Classifications | Jurisdiction | Performance Standard |
|---|
| P2, P3 | Australia/New Zealand | AS/NZS 1716:2012 |
| PFF2, PFF3 | Brazil | ABNT/NBR 13698:2011 |
| KN95, KP95, KN100, KP100 | China | GB2626-2006
GB2626-2019
GB19083-2010 |
| FFP2, FFP3 | Europe | EN 149-2001 |
| DS/DL2, DS/DL3 | Japan | JMHLW-2000 |
| Korea 1st class | Korea | KMOEL-2017-64 |
N95, P95, R95
N99, P99, R99
N100, P100, R100 | Mexico | NOM-116-2009 |
Podés leer el artículo completo en enlace **
Se habría eliminado la autorización de uso
de emergencia de varias de las máscaras
KN 95, fabricadas en china,pues habrían
fallado en los tests del NIOSH.( Podés leer
el texto original en inglés en el enlace arriba)
8)
¿QUÉ SUCEDIÓ EN EL MUNDO CON ESTAS
MÁSCARAS DE ORIGEN CHINO?
“Hasta la fecha, PHAC (Agencia de Salud Pública) identificó
aproximadamente un millón de máscaras KN95 que no cumplen con las
especificaciones para los entornos de atención médica. Estos artículos no se
distribuyeron a las provincias y territorios para la respuesta de atención de
salud de primera línea, y se están evaluando posteriormente para su uso en
entornos no relacionados con la atención de salud”.
"Tenían los filtros en mal estado y las cintas rotas.
El país se suma a la lista de estafados por el régimen de Beijing en la que ya están España, Canadá y Holanda"
"La Administración de Alimentos y Medicamentos (FDA) ha revocado la aprobación de más de 60 fabricantes de mascarillas del tipo N95 en China para exportarlas
a los Estados Unidos, después de que las pruebas realizadas revelaran que muchos de sus productos
no cumplían las normas de calidad."....""La decisión se produce en medio de una creciente reacción en contra de los equipos médicos de mala calidad fabricados en China durante la pandemia. Una lista creciente de países, desde Finlandia hasta los Países Bajos, han retirado o devuelto mascarillas, kits de test y trajes de protección defectuosos.
En abril, Missouri retiró miles de mascarillas KN95 provenientes de China que habían sido distribuidas a los servicios de emergencia, después de que las pruebas revelaran que no cumplían las normas-
10) VIDEO QUE CIRCULA EN REDES RESPECTO A KN95 Y FOTO DE LOS PRIMEROS
BARBIJOS RECIBIDOS
Q